Christian Tauscher, Sommersemester 2013
Die Korrosionsmessung in Beton gestaltet sich allgemein als schwierig und somit ist eine Kombination aus nachfolgenden Untersuchungsmethoden sinnvoll:
- Ultraschall-Echo-Verfahren
- Impakt-Echo-Verfahren
- RADAR
- Mikrowellenmesstechnik
- Induktive und kapazitive Verfahren
- Elektrochemische Potentialmessverfahren
- Endoskopie
- Monitoring-Systeme
- Radiografie
Es ist jedoch zu beachten, dass die Verfahren 1 bis einschließlich 5 nur zur Fehlstellenlokalisierung im Bauteil bzw. Auffinden von Bewehrungslagen geeignet sind. Eine Zustandsbeurteilung der Bewehrung hinsichtlich Korrosion ist damit nicht möglich. Die Methoden 7 bis 9 eignen sich ebenfalls nicht zur alleinigen Anwendung, werden aufgrund der Vollständigkeit jedoch genannt. So findet die Endoskopie als minimal-invasives Verfahren bei der optischen Kontrolle von Spannstählen in Hüllrohren oder bei Bewehrungskontrolle nach Bauteilöffnung Anwendung. Unter Monitoring-Systeme können sowohl Schwingungsanalyse, als auch „Korrosions-/Anodenleitern“ aufgeführt werden. Letztgenannte müssen jedoch schon beim Errichten des Bauwerks mit eingebaut werden und erfordern somit eine sorgfältige und intensive Vorplanung. Somit verbleibt das elektrochemische Potentialmessverfahren als derzeit einziges baustellentauglich einsetzbares Verfahren zur Korrosionsmessung in Beton.
Verfahrensbeschreibung
Mit der elektrochemischen Potentialmessung (häufig auch als Potentialfeldmessung bezeichnet) können Bereiche mit aktiv korrodierender Bewehrung im Stahlbetonbauteil detektiert werden, ohne das Bauteil zu zerstören. Korrosionsprozesse, die zum Zeitpunkt der Messung nicht ablaufen, können damit nicht lokalisiert werden. In der Regel erfolgt die Anwendung bei chloridinduzierter Korrosion. Dieses ortsveränderliche Verfahren wird eingesetzt bei:
- Ortung korrosionsaktiver Bereiche
- Bestandsaufnahme über Umfang und Verteilung von Bewehrungskorrosion an Stahlbetonbauwerken
- Vorbereitung von Instandsetzungsmaßnahmen
- Wiederkehrender Kontrolle und Überwachung
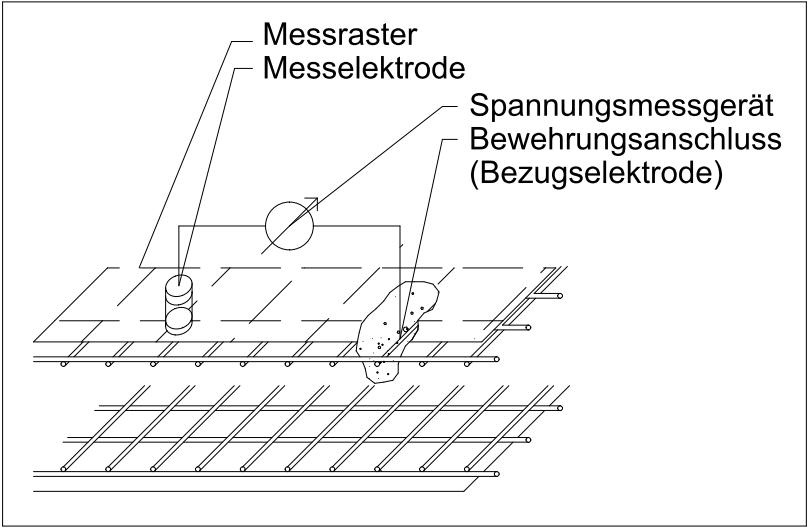
Es existieren zwei Möglichkeiten, die elektrochemische Potentialmessung durchzuführen: Bei der einen erfolgt die Spannungsmessung zwischen einer mobilen Bezugselektrode mit bekanntem Potential (z.B. Silber (Ag^+) / Silberchlorid (AgCl) oder Kupfer (Cu^+) / Kupfersulfat (CuSO_4)) - die je nach Messaufgabe als Stab- oder Radelektrode ausgeführt ist - und einer an die Bewehrung angekoppelten Messelektrode (siehe Abbildungen 1 und 2). Der für die Messung notwendige Kontakt zwischen Messelektrode und Betonoberfläche wird durch eine Elektrolyten (Leitungswasser) hergestellt, welche die Bauteiloberfläche über ein an der Elektrode angebrachtes Schwämmchen benetzt.
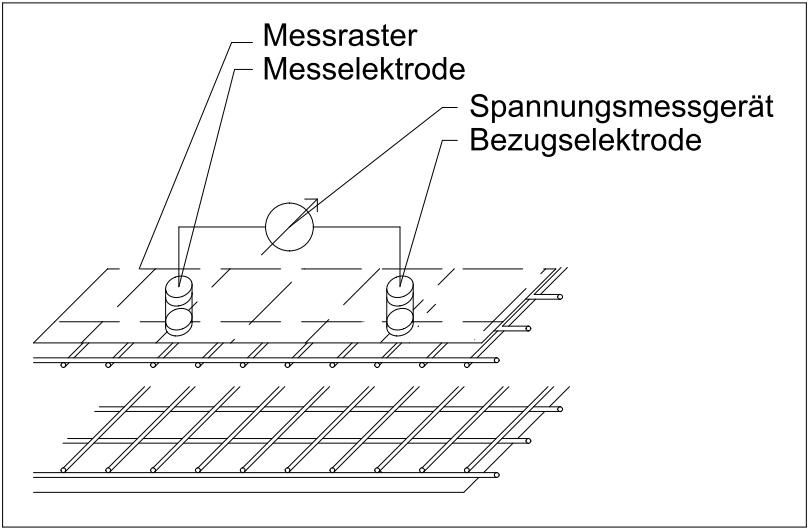
Bei der anderen Variante wird lediglich der Bewehrungsanschluss durch eine zweite Bezugselektrode ersetzt, die an der Betonoberfläche ortsfest befestigt wird (siehe Abbildung 3). Durch Abfahren eines vorher festgelegten Rasters auf der Betonoberfläche (min. 10 x 10 cm bis max. 50 x 50 cm) ist es möglich, mittels einem hochohmigen Spannungsmessgerät, Korrosionsstellen auf wenige Zentimeter genau zu lokalisieren. Dies erfolgt durch Auswertungen der unterschiedlichen gemessenen Potentiale entlang des Messrasters und den dabei auftauchenden großen Potentialdifferenzen, den sogenannten Potentialtrichtern. Sie entstehen bei der Annäherung der Messelektrode an die aktive Korrosionsstelle und ergeben ein steiles Gefälle in den Potentialen.
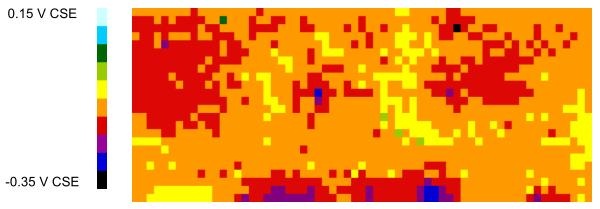
Um jedoch verbindliche Aussagen über den aktuellen Zustand der Bewehrung und den weiteren zu erwartenden Korrosionsfortschritt treffen zu können, ist eine Bauteilöffnung an einer Referenzstelle und einem Punkt mit sehr negativen Potential notwendig. Zu beachten ist allerdings auch, dass die elektrochemische Potentialmessung keine Absolutwerte liefert, sondern ausschließlich Potentialdifferenzen, was die Interpretation der Ergebnisse und Messüberwachung durch einen Fachmann unabdingbar macht. Eine Auswertung der Messung sollte mittels Farbgrafik (siehe Abbildung 4) und statistisch erfolgen.
| Abbildung 1: Messgerät mit Elektroden zur Potentialmessung | Abbildung 2: Prinzipskizze Potentialmessung mit Bewehrungsanschluss | Abbildung 3: Prinzipskizze Potentialmessung ohne Bewehrungsanschluss | Abbildung 4: Beispielhafte Ergebnisdarstellung einer Potentialmessung mittels Farbgrafik [1] |
Grundlagen der elektrochemischen Potentialmessung
Durch chemische und physikalische Vorgänge wird der pH-Wert des Betons herabgesetzt (> 12,5 auf unter 10) und die Korrosion von Stahl ermöglicht. Um diesen elektrochemischen Vorgang zu starten, sind nachfolgende Voraussetzungen notwendig:
- Depassivierung der Stahloberfläche (erfolgt zumeist durch Carbonatisierung oder Chloride)
- Elektrolytische Verbindung (Wasserzutritt, bzw. feuchter Beton)
- Sauerstoff
- Elektrochemische Potentialdifferenz
- Elektrische Verbindung [2][3]
Der dabei ablaufende aktive Korrosionsprozess lässt sich chemisch als anodischer Teilprozess (Eisenauflösung):
Anodischer Teilprozess: Fe \to Fe^{++} + 2e^-
und kathodischer Teilprozess (Sauerstoffreduktion): 2e^- + H_2O + \frac{1}{2} O_2 \to 2 (OH)^-
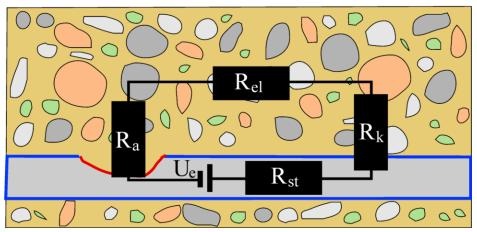
beschreiben. Dabei entsteht eine Potentialdifferenz zwischen Anode und Kathode, die mittels Spannungsmessung über Elektroden detektiert werden kann. Physikalisch lässt es sich qualitativ als Makroelement mit mehreren Widerständen als Modell abbilden und mit dem ohmschen Gesetz berechnen. Die Widerstände sind elektrisch leitend verbunden und aufgrund der Potentialdifferenzen kommt es zum Stromfluss. Der Widerstand des Stahls (R_{st}) wird dabei als vernachlässigbar gering angesehen. Die übrigen Widerstände beschreiben die Korrosionsstelle als Anode (R_a), den passiven Stahl als Kathode (R_k) und den Beton (R_{el}). Der fließende Korrosionsstrom I wird berechnet: I = \frac{U}{R} = \frac{U}{R_{u} + R_{k} + R_{el}} [1]
| Abbildung 5: Physikalisches Modell einer Korrosionszelle mit Widerständen [1] |
Grenzen der Potentialmessung [4]
- Ausmaß der Querschnittsverminderung der Bewehrung kann nicht direkt bestimmt werden (nur über Sondieröffnungen)
- Zum Erliegen gekommene Korrosionsherde, z.B. bei temporär oder dauernd trockenem Beton, können nicht detektiert werden
- Erlaubt keine direkte quantitative Aussage zur Korrosionsgeschwindigkeit
- Luft- und Betontemperatur sollte über +5 °C liegen (darunter Messung erschwert bis unmöglich)
- Keine Messung bei stehendem Wasser bzw. einem Eisfilm auf der Betonoberfläche möglich
- Keine Messung bei intakten isolierenden Beschichtungen der Betonoberfläche oder des Bewehrungsstahls (z.B. Bitumen oder Epoxidharz) möglich
Einflüsse auf das gemessene Potential [4]
- Haupteinflussfaktor ist der Korrosionszustand der Bewehrung. Hier beträgt das gemessene Potenzial bei passiver, nicht korrodierender Bewehrung zwischen +0,1 und –0,2 V CSE, bei korrodierender Bewehrung in chloridhaltigem Beton bis –0,6 V CSE, im karbonatisierten Beton bis –0,3 V CSE. Negativere Werte deuten auf höhere Wahrscheinlichkeit der Bewehrungskorrosion hin.
- Ein erhöhter Chloridgehalt im Beton verursacht negativeres Korrosionspotential und eine erhöhte Betonfeuchte.
- Bei dauernd nassen oder unter Wasser stehenden Bauteilen ergibt die Messung auch ohne aktive Korrosion sehr negative Werte. Wohingegen es bei einer inhomogenen Betonfeuchte im Bauteil zu Verschiebungen der Potentiale kommt. Eine Messung bei trockenem Beton ist nicht möglich, was den Einfluss von Betonfeuchte und –widerstand verdeutlicht.
- Karbonatisierter Beton ergibt einen erhöhten elektrischen Widerstand.
- Bei zunehmenden Sauerstoffgehalt und abnehmenden pH-Wert im Beton wird das Potential der passiven Bewehrung positiver.
- Eine größere Betondeckung der Bewehrung reduziert die Genauigkeit der Messung.
- Lufttemperaturen unter 5 °C sollte als unterer Grenzwert bei der Messdurchführung dienen, da sich die elektrochemischen Reaktionen an Bezugselektrode und Bewehrung ansonsten zu stark ändern.
- Der Einfluss von Betonzusammensetzung und –alter spielt ebenfalls eine große Rolle. So ergibt die Verwendung eines hohen Portlandzementgehalts (CEM I Zemente) geringere Potentialunterschiede als hüttensandhaltige Zemente (CEM III Zemente). CEM III Zemente verursachen deutlich tiefere Potentiale. Zudem werden bei „jungen“ Betonen (drei bis sechs Monate) negativere Potentiale als bei „älteren“ Betonen gemessen.
- Risse und Fugen führen zu stark schwankenden Potentialen.
- Kiesnester, Hohlstellen und reprofilierte Stellen ergeben aufgrund der fehlenden elektrolytischen Leitfähigkeit des umhüllenden Zements Fehler in der Messung.
- Metallische Einbauteile und freiliegende Bewehrung führen bei nassem Beton zu deutlich negativeren Potentialen, wohingegen der Einfluss bei trockenem Beton vernachlässigbar ist.
- Beläge, Abdichtungen und Oberflächenschutzsysteme erschweren die Durchführung einer Potentialfeldmessung oder können sie sogar vollständig verhindern.
Literatur
- Büchler, M., Schiegg,Y.: Untersuchungen zur Potentialfeldmessung an Stahlbetonbauten. Schweizerische Gesellschaft für Korrosionsschutz, Arbeitsgruppe Brückenforschung (AGB) Zürich. Zürich, 2008.
- Skriptum zur Vorlesung Schutz und Instandsetzung von Betonbauteilen. Volkwein, A. (Hrsg.), Lehrstuhl für Baustoffkunde und Werkstoffprüfung der Technischen Universität München. München, 2012.
- Merkblatt DGZfP B 3, Elektrochemische Potentialmessungen zur Detektion von Bewehrungsstahlkorrosion. Deutsche Gesellschaft für zerstörungsfreie Prüfung, 2008.
- Planung, Durchführung und Interpretation der Potentialmessung an Stahlbetonbauten. Schweizerischer Ingenieur- und Architektenverein, SIA Zürich. Zürich, 2013.